La malattia di Parkinson (MP) è una patologia cronica, neurodegenerativa e progressiva, caratterizzata dalla morte dei neuroni dopaminergici. Questo processo causa un deficit nella produzione di dopamina, che è a sua volta
responsabile delle manifestazioni motorie tipiche della malattia (Church, 2021) (Rahakrishanan et al., 2018).
In Italia sono stimati 170 mila casi prevalenti, riscontrando una lieve maggioranza per il sesso maschile e con una
durata media di malattia fra i 14-15 anni (Vanacore, 2004). La sua incidenza aumenta con l’avanzare dell’età,
interessando circa l’1% dei soggetti di età superiore a 65 anni (Church, 2021) (Rahakrishanan et al., 2018). I tassi
di incidenza raggiungono infatti i numeri più elevati fra i 70 e i 79 anni (Vanacore, 2004).
Attualmente è una patologia per cui non esiste una vera e propria cura, ma per cui è invece previsto un trattamento
unicamente sintomatologico che ne possa rallentare la progressione (Church, 2021). I sintomi caratteristici sono il tremore a riposo, la bradicinesia e la rigidità muscolare che sono responsivi al trattamento farmacologico e vengono anche detti sintomi cardine (Hausdorff et al., 2009) (Lieber et al., 2015). Ulteriori sintomi, difficilmente responsivi ai trattamenti, si sviluppano negli stadi avanzati di malattia (Hausdorff et al., 2009) (Lieber et al., 2015) (Brandmeir et al., 2018). Fra questi il più debilitante è l’instabilità posturale (IP) (Nilsson et al., 2011) (Crouse et al., 2016) che rappresenta la principale fonte di disabilità e di perdita di autonomia nel Parkinson (Hausdorff et al., 2009).
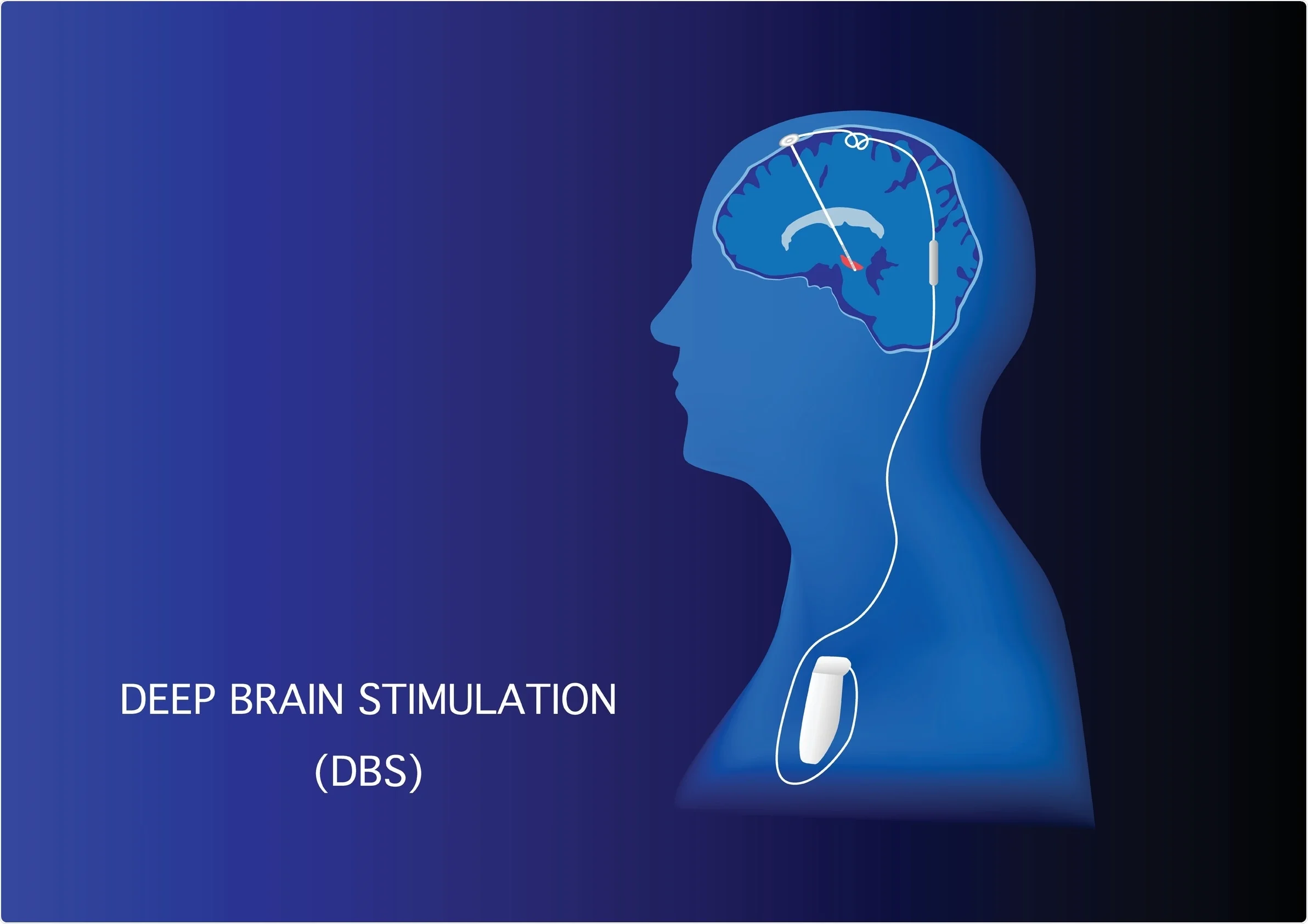
L’intervento neurochirurgico di Deep Brain Stimulation, o più comunemente detto DBS, è una procedura neurochirurgica utilizzata nel trattamento della MP (Lieber et al., 2015) (Krauss et al., 2021) (Fariba et al., 2022) e
consiste nel posizionamento di un elettrodo intracranico, collegato con un generatore di impulsi (Krauss et al., 2021)
(Fariba et al., 2022).
La DBS viene utilizzata per il trattamento, complementare o alternativo, nei casi in cui la terapia medica dovesse
fallire (Tagliati, 2008) (Nilsson et al., 2009). Il punto di forza del trattamento chirurgico è quello di poter consentire
una stimolazione costante nel tempo, permettendo così una riduzione del dosaggio farmacologico (Nilsson et al.,
2009). L’intervento consentirebbe inoltre un miglioramento dei sintomi che sviluppano resistenza alla terapia
dopaminergica, quali tremore a riposo, bradicinesia e rigidità muscolare (Brandmeir et al., 2018) (Karachi et al.,
2019) (Sidiropoulos et al., 2013); ancora invece non sono chiari gli effetti sui vari sintomi assiali, in particolare sull’IP
(Brandmeir et al., 2018) (Tagliati, 2008) (Sidiropoulos et al., 2013).
Le strutture che sono più comunemente utilizzate per l’impianto di stimolazione profonda sono il Nucleo Subtalamico o STN ed il Globo Pallido interno o GPi (Fariba et al., 2022). Recentemente, però, per poter ottenere un miglioramento delle problematiche di andatura e postura, è ritenuto opportuno mirare il trattamento a zone quali: il Nucleo Cuneiforme o CuN (Bourilhon et al. 2022) il Nucleo PeduncoloPontino o PPN (Moreau et al., 2008), di cui ne fa parte anche la Zona Caudale incerta o cZi (Khan et al. 2011) e che è collegato al campo H di Forel o FF (Rocha et al. 2021).
Le cadute accidentali ed il rischio di cadute nel Parkinson sono purtroppo frequenti (Nilsson et al., 2009). È infatti
dimostrato che tale rischio aumenti in diretta correlazione con la progressione di malattia (Grabli et al., 2012) e che
alla base di tali eventi c’è proprio l’instabilità posturale (Lieber et al., 2015) (Crouse et al., 2016).
Le cadute, a loro volta, provocano un aumento nel rischio di mortalità ed in quello di poter sviluppare morbilità. In
aggiunta, la disabilità che ne deriva potrebbe risultare in una perdita di autonomia, nella diminuzione della qualità di
vita e nella manifestazione della cosiddetta “paura di cadere” (FOF) (Grabli et al., 2012) e nell’isolamento sociale
(Crouse et al., 2016). La maggior parte delle cadute avvengono durante lo svolgimento di attività funzionali di vita
quotidiana (Grabli et al., 2012) (Nilsson et al. 2009), quando l’equilibrio viene messo alla prova da perturbazioni
intrinseche (Crouse et al., 2016) (Nilsson et al., 2009). I fattori contribuenti lo sviluppo di tali eventi, quindi, sono tutte quelle problematiche motorie che intaccano l’equilibrio e la postura (Nilsson et al., 2009).
Per la prevenzione delle cadute vengono considerati i fattori clinici predittivi come le precedenti cadute, la FOF o
anomalie del tono e della postura (Grabli et al., 2012); ma soprattutto possono essere sfruttati i test clinici che sono semplici, economici e che possono riflettere le attività di vita quotidiana (Nilsson et al., 2009).
Prosegui la lettura cliccando qui: Revisione della letteratura